การแตกตัวของกรด-เบสและนำ
การแตกตัวของกรด-เบสและนำ
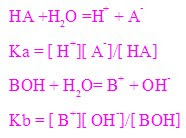
ที่มา http://www.thaigoodview.com/sites/all/modules/tinymce/tinymce/jscripts/tiny_mce/blank.htm
การแตกตัวของกรดแก่-เบสแก่
กรดแก่-เบสแก่จะมีความสามารถในการละลายน้ำให้สารละลายที่มีไอออนได้มากซึ่งแสดงว่ามีความแรงของกรดหรือเบสสูงในทางการคำนวณถือว่ากรดแก่-เบสแก่แตกตัวได้ร้อยเปอร์เซนต์ดังนั้นในการแตกตัวของกรดแก่และเบสแก่มีแต่เฉพาะปฏิกิริยาไปข้างหน้าจีงไม่เกิดสมดุลขี้น เช่น
NaOH Na+ + OH-
KOH K+ + OH-
การแตกตัวของกรดอ่อน-เบสอ่อน
กรดอ่อน-เบสอ่อนเมื่อละลายน้ำจะมีการละลายแตกตัวให้ไอออนในสารละลายได้น้อยคง
เหลือโมเลกุลของกรดอ่อนหรือเบสอ่อนอยู่มาก เกิดการเปลี่ยนแปลงที่ผันกลับได้ คือเกิดสมดุลขึ้นจึงสามารถหาค่าคงที่สมดุลของกรดอ่อน(Ka)หรือค่าคงที่สมดุลของ
เบสอ่อน(Kb)ได้นอกจากนี้ค่าคงที่ดังกล่าวยังสามารถบอกความแรงของกรดหรือเบสได้อีกด้วย
-ถ้า Ka ,Kb มากแสดงว่ากรดอ่อนหรือเบสอ่อนนั้นมีความแรงมาก
-ถ้าKa ,Kb น้อยแสดงว่ากรดอ่อนหรือเบสอ่อนนั้นมีความแรงน้อย
HA + H2O = H+ + A-
Ka = [ H+][ A-]/[ HA]
BOH + H2O = B+ + OH-
Kb = [ B+][ OH-]/[ BOH]
-ในกรณีMonoprotic Acid (HA)
HA + H2O =H3O+ +A-
Ka = [ H3O+][ A-]/[ HA]
-ในกรณี Diprotic Acid(H2A);Ka1>Ka2
H2A + H2O=H3O+ + HA- ;Ka1.(1)
HA- + H2O =H3O+ + A2- ;Ka2.(2)
H2A + 2 H2O =2H3O+ + A2- ;Ka
-ในกรณี Polyprotic Acid(> H2A )ได้แก่ H3A ;ka1 >ka2 >>ka3
สรุปสูตรการแตกตัวของกรดอ่อน
%การแตกตัว = [ H3O+] /Ca x100
-ในกรณีการแตกตัวของเบสอ่อน
%การแตกตัว = [ OH-] /Cb x100
การแตกตัวของน้ำ
น้ำกลั่น(distilled water)จัดเป็นอิเล็กโทรไลต์ที่อ่อนมากจึงแตกตัวออกเป็นไอออนได้น้อยดังสมการ
2H2O =H3O+ + OH-
K = [ H3O+ ][ OH-]/[ H2O]2
เนื่องจากน้ำแตกตัวได้น้อยมาก ดังนั้นความเข้มข้นของน้ำไม่เปลี่ยนแปลง
โดย[ H2O]บริสุทธิ์=55.56 mol/dm3
จาก K[ H2O]2 = [ H3O+ ][ OH-]
จะได้ kw =[ H3O+ ][ OH-]
ที่อุณหภูมิ 25oc kw = 1.0x10-14
จากสมการแสดงการแตกตัวของน้ำ พบว่า[ H3O+]และ[ OH-]ที่เกิดขึ้นเท่ากัน
ดังนั้น [ H3O+ ] = [ OH-]
kw=[ H3O+ ]2 = [ OH-]2
[ H3O+ ] = [ OH-]
kw =(1.0x10-14)power1/2
ดังนั้น[ H3O+ ] = [ OH-] =1.0x10-7 mol/dm3
สารที่เติมในน้ำ [H3O+] mol/dm3 [OH-] mol/dm3
กรดเบส >1.0x10-7<1.0x10-7 <1.0x10-7>1.0x10-7

ที่มา http://udata2.postjung.com/udata/0/765/765436/upic-736.gif
**********************************************
ทดสอบความเป็นกรด-เบสกับวัสดุหาง่ายยุค IMF
การรักษาสมดุลของกรด- เบสในมนุษย์







