การไฮโดรไลซิสเกลือ(1)


![]() ปฏิกิริยาไฮโดรไลซีสของเกลือ (Hydrolysis of Salts)
ปฏิกิริยาไฮโดรไลซีสของเกลือ (Hydrolysis of Salts)
ไฮโดรไลซีส หมายถึง ปฏิกิริยาระหว่างสาร(เกลือ) กับน้ำ
ไฮโดรไลซีสของเกลือ หมายถึง ปฏิกิริยาระหว่างเกลือกับน้ำ ซึ่งเกลือเป็นอิเล็กโทรไลต์แก่ เมื่อละลายน้ำแล้วจะแตกตัวออกเป็นไอออนบวกและลบทั้งหมด ดังนั้นสมบัติของสารละลายเกลือจึงขึ้นอยู่กับไอออนบวกและลบในสารละลายนั้น ไอออนบางตัวสามารถทำปฏิกิริยากับน้ำและให้ H+ หรือ OH- ได้ จึงเรียกว่า ปฏิกิริยาไฮโดรไลซีส เช่น
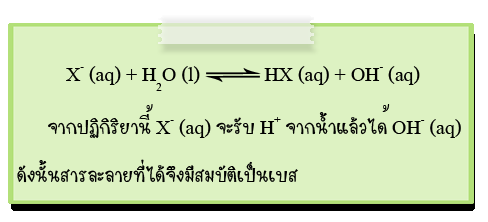

สรุปได้ว่า ถ้าไอออนลบของเกลือเกิดปฏิกิริยาไฮโดรไลซีสจะทำให้สารละลายแสดงความเป็นเบส แต่ถ้าไอออนบวกของเกลือเกิดปฏิกิริยาไฮโดรไลซีส จะทำให้สารละลายแสดงความเป็นกรด
![]() หลักในการพิจารณาว่าไอออนลบใดสามารถเกิดปฏิกิริยาไฮโดรไลซีสได้ มีหลักพิจารณา ดังนี้
หลักในการพิจารณาว่าไอออนลบใดสามารถเกิดปฏิกิริยาไฮโดรไลซีสได้ มีหลักพิจารณา ดังนี้
1. ไอออนลบของกรดแก่ เช่น Cl-, Br-, I-, NO3- และ ClO4- จะไม่ทำปฏิกิริยากับน้ำ จึงทำให้ไม่มีผลต่อความเป็นกรด - เบสของสารละลาย
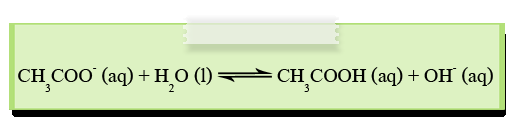
2. ไอออนลบของกรดอ่อน เช่น CH3COO-, ClO-, CN- และ CO32- จะรับโปรตอนจากน้ำ ทำให้เกิดปฏิกิริยาไฮโดรไลซีสได้สารละลายที่มีความเป็นเบส เช่น
![]() หลักในการพิจารณาว่าไอออนบวกใดสามารถเกิดปฏิกิริยาไฮโดรไลซีสได้ มีหลักพิจารณาดังนี้
หลักในการพิจารณาว่าไอออนบวกใดสามารถเกิดปฏิกิริยาไฮโดรไลซีสได้ มีหลักพิจารณาดังนี้
1. ไอออนบวกของโลหะหมู่ IA หรือ IIA (ยกเว้น Be) ได้แก่ Li+, Na+, K+, Mg2+, Ca2+ และ Ba2+ จะไม่เกิดปฏิกิริยาไฮโดรไลซีส รวมถึงไอออนบวกของเบสแก่ทั้งหมดด้วย
2. NH3+ ของเกลือแอมโมเนียม จะเกิดปฏิกิริยาไฮโดรไลซีสจึงทำให้สารละลายเป็นกรด