การผุกร่อน

การผุกร่อนโลหะและการป้องกัน
เมื่อโลหะเกิดปฏิกิริยาออกซิเดชันหรือถูกออกซิไดซ์ จะมีการกร่อนของโลหะนั้น ๆ เกิดขึ้น
ดังนั้นหลักของการป้องกันการกร่อนก็คือ การป้องกันไม่ให้โลหะเกิดปฏิกิริยาออกซิเดชันนั่นเอง
โลหะที่มีค่า E๐ ครึ่งเซลล์รีดักชันสูงที่สุดได้แก่ ทองคำจะสามารถทนต่อการกร่อนได้มากที่สุด
ทองคำจึงเป็นโลหะมีค่า แพลตินัม เงิน และทองแดงที่มีค่า E๐ ครึ่งเซลล์รีดักชันเป็นบวกก็มี
ความสามารถทนต่อการกร่อนได้ดีรองลงมา ส่วนโลหะอื่น ๆ ก็จะเป็นโลหะที่ถูกออกซิไดซ์ได้ง่าย
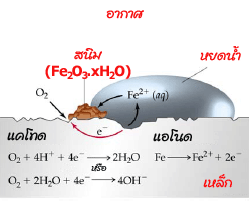
นั่นคือมีโอกาสกร่อนได้ง่ายกว่า ตัวอย่างการกร่อนที่พบได้บ่อยและชัดเจนคือการเกิดสนิมเหล็กหรือ
การเกิดออกไซด์ของเหล็ก เหล็กเป็นสนิมได้ก็ต่อเมื่อมีแก๊สออกซิเจนและน้ำอยู่ด้วย
ปฏิกิริยาการเกิดสนิมเหล็กค่อนข้างซับซ้อนและมีลักษณะเฉพาะตัว แต่เชื่อว่ามีขั้นตอนที่สำคัญคือ
http://www.il.mahidol.ac.th/e-media/electrochemistry/web/electrochem04.htm
ปฏิกิริยาออกซิเดชันเกิดขึ้นเมื่อพื้นผิวส่วนหนึ่งของเหล็กทำหน้าที่เป็นแอโนด ดังสมการ
Fe(s) --> Fe2+(aq) + 2e-
ออกซิเจนถูกรีดิวซ์ที่ผิวอีกส่วนหนึ่งของเหล็กซึ่งทำหน้าที่เป็นแคโทด เมื่อมีน้ำอยู่ด้วย ดังสมการ
2O2 (g) + 4H2O(l) + 8e- 8OH-(aq)
และมีปฏิกิริยาต่อเนื่องต่อไปคือ
4Fe2+(aq) + 8OH-(aq) --> 4Fe(OH)2 (aq)
4Fe(OH)2 (aq) + O2 (g) --> 2Fe2O3.2H2O(s) + H2O(l)
Fe2O3.2H2O คือสนิมเหล็ก









