สารละลายอิเล็กโทรไลต์+ชนิดของกรด-เบส


![]() สารละลายอิเล็กโทรไลต์
สารละลายอิเล็กโทรไลต์
อิเล็กโทรไลต์ (Electrolyte) หมายถึง สารที่ละลายในตัวทำละลายแล้วสามารถแตกตัวเป็นไอออนได้ ส่งผลให้นำไฟฟ้าได้ โดยสารละลายอิเล็กโทรไลต์นี้ แบ่งเป็น 2 ประเภท ดังนี้
1. อิเล็กโทรไลต์แก่ คือ สารที่ละลายในตัวทำละลายแล้วสามารถแตกตัวเป็นไอออนได้ดีมาก หรือ แตกตัวได้หมด (100%) ทำให้สามารถนำไฟฟ้าได้ดีมาก เช่น NaCl , KNO3 , Ca(OH)2 เป็นต้น
2. อิเล็กโทรไลต์อ่อน คือ สารที่ละลายในตัวทำละลายแล้วสามารถแตกตัวเป็นไอออนได้น้อย หรือแตกตัวได้เพียงบางส่วนเท่านั้น (< 100%) ทำให้นำไฟฟ้าได้น้อย เช่น HF , HCN เป็นต้น
นอนอิเล็กโทรไลต์ (Non-electrolyte) หมายถึง สารที่เมื่อนำมาละลายน้ำแล้วจะไม่สามารถแตกตัวเป็นไอออนได้ ทำให้ไม่สามารถนำไฟฟ้าได้ เช่น น้ำบริสุทธิ์ น้ำตาล แอลกอฮอล์ เป็นต้น

![]() ชนิดของกรด แบ่งตามลักษณะการแตกตัว ได้ 3 ชนิด ดังนี้
ชนิดของกรด แบ่งตามลักษณะการแตกตัว ได้ 3 ชนิด ดังนี้
1. กรด Monoprotic หมายถึง กรดที่สามารถแตกตัวได้ 1 ขั้น ได้แก่ HNO3, HClO3, HClO4, HCN เป็นต้น
2. กรด Diprotic หมายถึง กรดที่สามารถแตกตัวได้ 2 ขั้น ได้แก่ H2SO4, H2CO3 เป็นต้น
3. กรด Polyprotic หมายถึง กรดที่สามารถแตกตัวได้ 3 ขั้น ได้แก่ H3PO4 เป็นต้น
ในกรณีที่เป็นการแตกตัวของกรด Polyprotic นั้น การแตกตัวแต่ละครั้งจะให้ H+ ไม่เท่ากัน โดยค่า Ka ของการแตกตัวครั้งแรกจะมีค่าสูงมาก แต่เมื่อแตกครั้งต่อๆไปจะมีค่า Ka ต่ำมาก เพราะประจุลบในไอออนดึงดูด H+ ไว้ดังสมการ
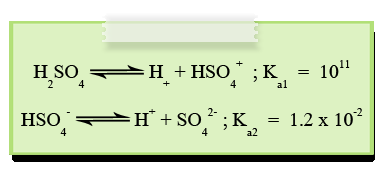
เนื่องจากกรด Polyprotic ส่วนใหญ่มักมีค่า K1 >> K2 >> K3 ดังนั้น H+ ในสารละลายส่วนใหญ่จะได้มาจากการแตกตัวครั้งแรก
ถ้าค่า K1 มากกว่า K2 = 103 เท่าขึ้นไป จะพิจารณาค่าความเข้มข้นของ [H+] ของสารละลายกรด Polyprotic ได้จากค่า K1 เท่านั้น แต่ถ้าค่า K2 มีค่าไม่ต่ำมาก จะต้องนำค่า K2 มาพิจารณาด้วย
![]() ชนิดของเบส แบ่งตามจำนวน OH - ในเบส ได้ 3 ชนิด ดังนี้
ชนิดของเบส แบ่งตามจำนวน OH - ในเบส ได้ 3 ชนิด ดังนี้
1. เบสที่มี OH- หมู่เดียว เช่น LiOH, NaOH, KOH, RbOH, CsOH เป็นต้น
2. เบสที่มี OH-2 หมู่ เช่น Ca(OH)2, Sr(OH)2, Ba(OH)2 เป็นต้น