เซลล์กัลวานิก
เซลล์กัลวานิกหรือเซลล์วอลเตอิก ( Galvanic Cells or Voltaic Cell)
คือ เซลล์ไฟฟ้าเคมีหรือระบบที่ทำหน้าที่เปลี่ยนพลังงานเคมีเป็นพลังงานไฟ้า โดยภายในเซลล์เกิดปฏิกิริยาการถ่ายโอนอิเล็กตรอนจากสารหนึ่งไปอีกสารหนึ่ง(ปฏิกิริยารีดอกซ์) โดยที่สารตั้งต้นไม่ได้สัมผัสกันโดยตรง ทำให้การไหลของอิเล็กตรอนผ่านตัวนำอย่างต่อเนื่อง จึงเกิดกระแสไฟฟ้าไหลในวงจร
เซลล์กัลวานิก ประกอบด้วยสองครึ่งเซลล์ แต่ละครึ่งเซลล์มักประกอบด้วยโลหะ ซึ่งเป็นขั้วไฟฟ้าจุ่มอยู่ในสารละลายของไอออนของโลหะนั้น ทำหน้าที่เป็นสารละลายอิเล็กโทรไลต์ แต่ในบางครึ่งเซลล์ประกอบด้วยอโลหะกับอโลหะไอออน หรือไอออนสองชนิด กรณีนี้มักใช้ขั้วเฉื่อย เป็นขั้วไฟฟ้า เพราะอโลหะหรือไอออนไม่สามารถเป็นขั้วไฟฟ้าได้
เช่น มีก๊าซ H2 อยู่ร่วมกับ H+ หรือ ก๊าซ Cl2 อยู่ร่วมกับ Sn4+ โดยมี Pt เป็นขั้วไฟฟ้า เป็นต้น (ขั้วไฟฟ้าเฉื่อย ไม่มีส่วนในการเกิดปฏิกิริยารีดอกซ์ เพียงแต่ทำหน้าที่ให้กระแสอิเล็กตรอนหรือกระแสไฟฟ้าไหลผ่านเท่านั้น)
เซลล์กัลวานิก เป็นเซลล์ไฟฟ้าที่สามารถผลิตไฟฟ้าให้เกิดขึ้นได้เองด้วยปฏิกิริยารีดอกซ์ ในการศึกษาปฏิกิริยารีดอกซ์ เราใช้แผ่นโลหะจุ่มในสารละลายโดยตรง แต่ในเซลล็ไฟฟ้าเคมี แผ่นโลหะที่จะเกิดปฏิกิริยากับสารละลาย จะอยู่ในภาชนะต่างกัน แล้วนำมาต่อเชื่อมกัน เชลล์ไฟฟ้าจึงประกอบด้วยภาชนะ 2 ใบ เรียกภาชนะแต่ละใบว่า ครึ่งเซลล์( Half Cell)
ครึ่งเซลล์ คือ แผ่นโลหะที่จุ่มในสารละลายของไอออนของโลหะนั้นหรือก๊าซที่พ่นลงในสารละลายของก๊าซนั้น แผ่นโลหะหรือก๊าซที่จุ่มอยู่ในสารละลายเรียกว่า ขั้วไฟฟ้า ขั้วไฟฟ้าจะมี 3 ชนิด
1. ขั้วไฟฟ้าโลหะ คือ แผ่นโลหะที่จุ่มในสารละลายของไอออนของโลหะนั้น ขั้วโลหะจะทำหน้าที่ เกิดปฏิกิริยาและนำอิเล็กตรอน
2. ขั้วไฟฟ้าก๊าซ คือ ก๊าซที่พ่นลงไปในสารละลาย ก๊าซจะทำหน้าที่ในการเกิดปฏิกิริยา แต่นำอิเล็กตรอนไม่ได้ จึงต้องใช้ร่วมกับขั้วไฟฟ้าเฉื่อย
3. ขั้วไฟฟ้าเฉื่อย เป็นขั้วไฟฟ้าที่ช่วยนำอิเล็กตรอน แต่ไม่มีส่วนร่วมในการเกิดปฏิกิริยาต้องใช้ร่วมกับขั้วไฟฟ้าก๊าซ ขั้วไฟฟ้าเฉื่อย
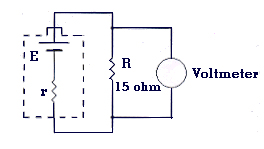
เมื่อนำครึ่งเซลล์ที่ต่างกัน 2 ครึ่งเซลล์ มาต่อเชื่อมเข้าด้วยกัน โดยเชื่อมวงจรภายในด้วยสะพานไอออนและเชื่อมวงจรภายนอกด้วยตัวต้านทาน จะเกิดการไหลของอิเล็กตรอนขึ้น อิเล็กตรอนไหลไปทางใด เข็มโวลต์มิเตอร์จะเบนไปในทิศทางนั้น
เซลล์กัลวานิกประกอบด้วยสองครึ่งเซลล์ โดยแต่ละครึ่งเซลล์จะประกอบด้วยขั้วไฟฟ้าที่จุ่มลงไปในสารละลาย แท่งสังกะสีและแท่งทองแดงในเซลล์เป็นขั้วไฟฟ้าซึ่งเรียกว่า อิเล็กโทรด (electrode) ขั้วที่เกิดปฏิกิริยาออกซิเดชัน เรียกว่า ขั้วแอโนด (anode) และขั้วที่เกิดปฏิกิริยารีดักชัน เรียกว่า ขั้วแคโทด (cathode)
- ปฏิกิริยาออกซิเดชันที่แอโนด (Zn) Zn(s) → Zn 2+ (aq) + 2e -
- ปฏิกิริยารีดักชันที่แคโทด (Cu) Cu 2+ (aq) + 2e- → Cu(s)
หมายเหตุ : ประจุที่สะสมจะทำให้ออกซิเดชันที่แคโทดและรีดักชันที่แอโนดเกิดยากขึ้น ระหว่างที่เกิดปฏิกิริยาออกซิเดชันขึ้นที่ขั้วแอโนด Zn จะค่อย ๆ กร่อนแล้วเกิดเป็น Zn 2+ ละลายลงมาในสารละลายที่มี Zn 2+ และ SO 4 2- ส่วนที่ขั้วแคโทด Cu 2+ จากสารละลายเกิดปฏิกิริยารีดักชันกลายเป็นอะตอมของทองแดงเกาะอยู่ที่ผิวของขั้วไฟฟ้า เมื่อปฏิกิริยาดำเนินไปจะพบว่าในครึ่งเซลล์ออกซิเดชันสารละลายจะมีประจุบวก (Zn 2+ ) มากกว่าประจุลบ (SO 4 2- ) และในครึ่งเซลล์รีดักชันสารละลายจะมีประจุลบ (SO 4 2- ) มากกว่าประจุบวก (Cu 2+ ) จึงเกิดความไม่สมดุลทางไฟฟ้าขึ้น ปัญหานี้สามารถที่จะแก้ไขได้โดยการใช้ สะพานเกลือ (salt bridge) เชื่อมต่อระหว่างสองครึ่งเซลล์ ซึ่งสะพานเกลือทำจากหลอดแก้วรูปตัวยู ภายในบรรจุอิเล็กโตรไลต์ที่ไม่ทำปฏิกิริยากับสารในเซลล์และมีไอออนบวก ไอออนลบเคลื่อนที่ด้วยความเร็วใกล้เคียงกัน หรือทำจากกระดาษกรองชุบอิเล็กโตรไลต์ โดยสะพานเกลือทำหน้าที่เป็นตัวกลางที่เชื่อมต่อระหว่างครึ่งเซลล์ทั้งสอง และเป็นสิ่งที่ป้องกันการเกิดการสะสมของประจุโดยไอออนบวกจากสะพานเกลือจะเคลื่อนที่ไปยังครึ่งเซลล์ที่มีประจุลบมาก ในทางตรงกันข้ามไอออนลบก็จะเคลื่อนที่ไปยังครึ่งเซลล์ที่มีประจุมาก จึงทำให้ปฏิกิริยาดำเนินต่อไปได้ในเวลาที่มากขึ้น และเนื่องจากครึ่งเซลล์ทั้งสองเชื่อมต่อกับวงจรภายนอก ครึ่งเซลล์ที่มีศักย์รีดักชันสูงกว่าจะเกิดรีดักชัน และครึ่งเซลล์ที่มีศักย์รีดักชันต่ำกว่าจะ(ถูกบังคับให้)เกิดออกซิเดชัน ความต่างศักย์ระหว่างอิเล็กโทรดนี้ เรียกว่า แรงเคลื่อนไฟฟ้า (electromotive force: emf) และมีหน่วยเป็น โวลต์ (volt)
สะพานไอออนหรือเกลือ (Salt Bridge )
ส่วนประกอบของสะพานไอออน คือ เป็นหลอดแก้วรูปตัวยู ภายในบรรจุสารละลายของเกลือที่อิ่มตัว ปลายของข้างปิดด้วยสำลีหรือใยแก้ว
สมบัติของเกลือที่จะใช้ทำสะพานไอออน คือ
1. ละลายน้ำได้ดี และแตกตัวได้ 100%
2. ต้องไม่ทำปฏิกิริยากับสารใดๆ ที่อยู่ภายในครึ่งเซลล์ทั้งสอง
3. ไอออนบวก และแลบ ที่ได้จากการแตกตัว จะเคลื่อนที่ด้วยความเร็วเท่าๆกัน
วิธีทำสะพานไอออน
นำเหลือทีเหมาะสม ละลายน้ำจนอิ่มตัว แล้วผสมกับวุ้นในสัดส่วนที่พอเหมาะ อุ่นให้วุ้นละลายแล้วเทในหลอดแก้วรูปตัวยู ปิดปลายหลอดแก้ว
หลักการเขียนแผนภาพเซลล์กัลวานิก
1. เขียนครึ่งเซลล์ออกซิเดชันไว้ทางด้านซ้ายของสะพานไอออน และเขียนครึ่งเซลล์รีดักชันไว้ทางด้านขวาของสะพานไอออน
2. ใช้เครื่องหมาย // แทนสะพานไอออน
3. ในครึ่งเซลล์ออกซิเดชัน เขียนโลหะที่เป็นแอโนดไว้ซ้ายสุด ตามด้วยโลหะไอออนคั่นกลางด้วย /
4. ในครึ่งเซลล์รีดักชัน เขียนโลหะไอออนก่อน แล้วเขียนโลหะที่เป็นแอโนดไว้ขวาสุด คั่นกลางด้วย /
5. ในครึ่งเซลล์ใดๆที่มีสารสถานะเดียวกันมากกว่า 1 ชนิดให้ใช้เครื่องหมาย ( , ) คั่นระหว่างสารที่สถานะเดียวกัน
6. ถ้าต้องการระบุความเข้มข้น หรือความดันให้เขียนไว้ในวงเล็บหลังสารชนิดนั้นๆ
7. ถ้าเป็นขั้วไฟฟ้า ก๊าซจะต้องใส่ขั้วไฟฟ้าเฉื่อยคือ Pt หรือ C เป็นขั้วไฟฟ้า
ตัวอย่าง
Zn ----> Zn+ + 2 e -………… (1) Oxidation Reaction
Cu 2+ + 2 e- -----> Cu ………… .(2) Reduction Reaction
Zn + Cu 2+ -----> Cu + Zn 2+ ………… . (3) Redox Reaction
จากตัวอย่างสามารถเขียนแผนภาพของเซลล์ได้ดังนี้
Zn ( s ) / Zn 2+ ( aq, 1 M ) // Cu 2+ ( aq, 1 M ) / Cu ( s )
การหาค่าศักย์ไฟฟ้าครึ่งเซลล์มาตรฐาน (E๐หาโดยตรงไม่ได้ต้องมีอิเล็กโทรดมาเปรียบเทียบ (Reference Electrode) ได้แก่
1. โลหะตะกั่ว
2. ก๊าซ H2 แล้วกำหนดให้ศักย์ของครึ่งเซลล์เปรียบเทียบเท่ากับศูนย์ แต่โดยทั่วไปไม่นิยมใช้โลหะเป็นอิเล็กโทรดเปรียบเทียบ เนื่องจากควบคุมความบริสุทธิ์ยากจึงหันมาให้ใช้ก๊าซ H2 แทน
การใช้ก๊าซ H2 เป็นอิเล็กโทรดเปรียบเทียบ ตามปกติก๊าซ H2 ไม่นำไฟฟ้าและเกิดปฏิกิริยายาก จึงต้องใช้โลหะ Pt เป็นขั้วไฟฟ้าปละมี Pt Black เคลือบอยู่เพื่อช่วยให้เกิดปฏิกิริยาง่ายขึ้น จุ่มในสารละลายของกรด HCl และมีท่อก๊าซ H2 ผ่านลงไป

จากรูป ขั้วลบ(Anode) คือ H2 ขั้วบวก(Cathode) คือ Cu แผนภาพเซลล์ไฟฟ้าเคมี Pt(s) | H2(g) | H+(aq) || Cu2+(aq) | Cu(s) ศักย์ไฟฟ้าของเซลล์ = ศักย์ไฟฟ้าที่แคโทด(ขั้วบวก) - ศักย์ที่แอโนด(ขั้วลบ)
E(เซลล์) = ศักย์ Cu - ศักย์ H2
E(เซลล์) = ศักย์ Cu - 0
ดังนั้น ศักย์ครึ่งเซลล์ของ Cu = + (มีค่าเป็นบวกแสดงว่า Cu2+ ชิง e ดีกว่า H+) แต่ค่าศักย์ไฟฟ้าครึ่งเซลล์ (E) ขึ้นอยู่กับองค์ประกอบหลายอย่างคือ
1. ความเข้มข้นของสารละลาย
2. อุณหภูมิ
3. ความดัน (ถ้าเป็นก๊าซ)
4. ชนิดของขั้ว
จากองค์ประกอบทั้ง 5 ข้อ จึงต้องกำหนดมาตรฐานโดยใช้ความดัน 1 โมล/ลิตร , T = 0.25 0C, ความดัน = 1 บรรยากาศ (E -> E0)
ดังนั้น เราจึงเรียกศักย์ไฟฟ้าครึ่งเซลล์ ณ ภาวะมาตรฐานว่า ศักย์ไฟฟ้าครึ่งเซลล์มาตรฐาน (E0) และค่า E0 ไม่ขึ้นกับปริมาณ
สรุป
1. ถ้า E0 เป็นบวกแสดงว่าครึ่งเซลล์นั้นชิง e- ได้ดีกว่าครึ่งเซลล์ H2 ถ้า E0 เป็นลบแสดงว่าครึ่งเซลล์นั้นชิง e- สู้ครึ่งเซลล์ H2 ไม่ได้
2. ถ้า E0 บวกมากชิง e- ดีกว่าบวกน้อย > 0 > ลบน้อย > ลบมาก
ประโยชน์ของค่าศักย์ไฟฟ้าครึ่งเซลล์มาตรฐาน
1. ใช้เรียงลำดับการชิง e- หรือตัวออกซิไดซ์
2. ใช้เรียงลำดับการให้ e- หรือตัวรีดิวซ์
3. ใช้บอกให้ทราบถึงขั้วบวก ขั้วลบ แอโนด แคโทด ความต่างศักย์ แผนภาพ ปฏิกิริยา และอื่นๆ เมื่อนำครึ่งเซลล์มาต่อเข้าด้วยกัน
4. ใช้บอกให้ทราบว่าโลหะใดใช้ป้องกันการผุของ Fe ได้ (โดยเสีย e- ง่ายกว่า Fe)
5. ใช้บอกให้ทราบว่าโลหะใดทำให้ Fe ผุเร็วขึ้น (โดยเสีย e- ยากกว่า Fe)
6. ใช้ทำนายการเกิดปฏิกิริยาได้หรือไม่ได้ โดยการหาค่า E0 ของเซลล์ตามโจทย์กำหนด ถ้า
E0 ของเซลล์เป็นวกเกิดได้ ถ้า E0 ของเซลล์เป็นลบเกิดไม่ได้ (หมายถึง เกิดตรงกันข้าม) แต่ไม่บอกว่าเกิดเร็วหรือช้า (อัตราเร็ว) หรือเกิดมากหรือน้อย
ตัวอย่าง จากค่า E0 ต่อไปนี้
Zn2+ + 2e- ------> Zn
E0 = - 0.76
Fe2+ + 2e- -------> Fe
E0 = - 0.44
Cl2 + 2e- -------> 2Cl-
E0 = + 1.36
H2 + 2e- ------> 2H+
E0 = 0.00
Cu2+ + 2e- ------> Cu
E0 = + 0.34
1. การเรียงลำดับการชิง e- หรือตัวออกซิไดซ์จากมากไปน้อย (ซ้ายมือ) + มาก ชิง e - ดีกว่า + น้อย Cl2 , Cu2+ , H+ , Fe2+ , Zn2+
2. การเรียงลำดับการให้ e- จากง่ายไปยากหรือตัวรีดิวซ์จากมากไปน้อย (ขวามือ) Zn , Fe , H2 , Cu , Cl-
3. เมื่อนำครึ่งเซลล์ Zn ต่อกับครึ่งเซลล์ Cu การหาขั้วบวก ขั้วลบ แอโนด แคโทด ศักย์ของเซลล์(ความต่างศักย์) หาได้ดังนี้

ความต่างศักย์ ศักย์ที่ขั้วบวก (แคโทด) - ศักย์ที่ขั้วลบ (แอโนด)
= ศักย์ของเซลล์ (E0 เซลล์)
= Cu - Zn
= + 0.34 - (-0.76)
= + 1.10 Volts
แผนภาพเซลล์กัลวานิก Zn / Zn2+ || Cu2+ / Cu
ปฏิกิริยา ครึ่งเซลล์แอโนด Zn --------> Zn2+ + 2e-
ครึ่งเซลล์แคโทด Cu2+ + 2e- ----------> Cu
ทั้งเซลล์ (Redox) ทำให้ หมดไป (1) + (2)
Zn + Cu2+ ---------> Cu + Zn2+
4. โลหะที่ป้องกันการผุกร่อนของ Fe ได้ (โลหะที่เสีย e ง่ายกว่า Fe) ก็คือ โลหะ Zn
5. โลหะที่ทำให้ Fe ผุเร็วขึ้น (โลหะที่เสีย e ยากกว่า Fe) ก็คือ โลหะ Cu
หลักการใช้ค่า E0ทำนายการเกิดปฏิกิริยารีดอกซ์
1. เขียนสมการตามโจทย์กำหนด
2. หาขั้วแคโทด (ขั้วที่เกิดปฏิกิริยา Reduction) และขั้วแอโนด (ขั้วที่เกิดปฏิกิริยา Oxidation) ตามโจทย์กำหนดในสารตั้งต้น
3. หาค่า E0 ของเซลล์จากสมการ E0 เซลล์ = E0 แคโทด - E0 แอโนด ถ้า E0 ของเซลล์ออกมาเป็นบวกแสดงว่าปฏิกิริยานี้เกิดขึ้นได้ เช่น Zn + 2H+ ----> Zn2+ + H2 E0 เซลล์ = +0.76 volts Cu + 2H+ ----> Cu2+ + H2 E0 เซลล์ = -0.34 volts ถ้า E0 ของเซลล์ออกมาเป็นลบแสดงว่าปฏิกิริยาไม่เกิดแต่เกิดตรงกันข้าม เช่น Cu2+ + H2 ----> Cu + 2H+ E0 เซลล์ = +0.34 volts
เซลล์กัลวานิกจำแนกได้ 2 ประเภท คือ
1. เซลล์ปฐมภูมิ หมายถึง เซลล์กัลวานิกที่ปฏิกิริยาเคมีภายในเซลล์เกิดขึ้นอย่างสมบูรณ์ และทำให้เกิดปฏิกิริยาย้อนกลับไม่ได้ หรือเป็นเซลล์ที่เมื่อใช้จนหมดแล้วไม่สามารถนำมาอัดไฟใหม่ได้
2. เซลล์ทุติยภูมิ หมายถึง เซลล์กัลวานิกที่ปฏิกิริยาเคมีภายในเซลล์เมื่อเกิดขึ้นแล้วสามารถทำให้เกิดย้อนกลับได้อีก โดยการอัดไฟเข้าไปใหม่ หรือหมายถึงเซลล์ที่เมื่อใช้ไฟหมดแล้วสามารถนำมาอัดไฟใหม่ได้อีก
เซลล์ปฐมภูมิ
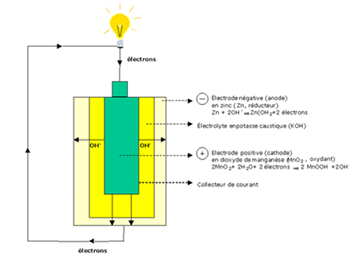
1. ถ่านไฟฉายหรือเซลล์แห้งหรือเซลล์เลอคลังเช ประกอบด้วย กล่องสังกะสีเป็นขั้วแอโนด และมีแท่งคาร์บอนอยู่ตรงกลางเป็นแคโทด รอบ ๆ แท่งคาร์บอนมีแมงกานีส (IV) ออกไซด์ ผสมผงคาร์บอนโดยอัดติดกับแท่งคาร์บอน และรอบ ๆ แท่งคาร์บอนซึ่งหุ้มด้วยแมงกานีส (IV) ออกไซด์ผสมผงคาร์บอนมีสารละลายของแอมโมเนียคลอไรด์ซึ่งทำหน้าที่เป็นอิเล็กโทรไลต์บรรจุอยู่ เนื่องจากสารละลายของแอมโมเนียคลอไรด์เป็นของรั่วได้ง่ายจึงผสมกาวลงไปด้วย ด้านนอกของกล่องอาจหุ้มด้วยกระดาษแข็งหรือโลหะ โดยทั่วไปเซลล์ปฐมภูมิชนิดนี้มีศักย์ไฟฟ้า
2. เซลล์แอลคาไลน์ มีส่วนประกอบและหลักการเดียวกับถ่านไฟฉาย แต่ใช้สารละลาย KOH เป็นอิเล็กโทรไลต์ ซึ่งมีสมบัติเป็นเบส เซลล์ชนิดนี้มีศักย์ไฟฟ้าเท่ากับเซลล์แห้งแต่ให้กระแสไฟฟ้าได้นานกว่า เนื่องจากน้ำและไฮดรอกไซด์ไอออนที่เกิดขึ้นในปฏิกิริยาหมุนเวียนกลับไปเป็นสารตั้งต้นของปฏิกิริยาได้อีก
3. เซลล์ปรอท อาศัยหลักการเดียวกับเซลล์แอลคาไลน์ แต่ใช้เมอคิวรี (II) ออกไซด์แทนแมงกานีส (IV) ออกไซด์ เซลล์ปรอทให้ศักย์ไฟฟ้าประมาณ 1.3 โวลต์ ให้กระแสไฟฟ้าต่ำ แต่มีข้อดีที่สามารถให้ศักย์ไฟฟ้าเกือบคงที่ตลอดอายุการใช้งาน นิยมใช้กันมากในเครื่องฟังเสียงสำหรับคนหูพิการ

4. เซลล์เงิน มีส่วนประกอบเช่นเดียวกับเซลล์ปรอท แต่ใช้ซิลเวอร์ออกไซด์แทนเมอร์คิวรี (II) ออกไซด์ เซลล์เงินให้ศักย์ไฟฟ้าประมาณ 1.5 โวลต์ มีขนาดเล็กและมีอายุการใช้งานได้นานมากแต่มีราคาแพง จึงใช้กับอุปกรณ์หรือเครื่องใช้ไฟฟ้าบางชนิด เช่น นาฬิกา เครื่องคิดเลข
เซลล์ทุติยภูมิ

1. เซลล์นิกเกิล – แคดเมียม หรือเซลล์นิแคด มีโลหะเมียมเป็นแอโนด นิกเกิล (IV) ออกไซด์เป็นแคโทด และมีสารละลายเบสเป็นอิเล็กโทรไลต์ เซลล์นิแคดให้ศักย์ไฟฟ้าประมาณ 1.4 โวลต์ เมื่อใช้งานจนศักย์ไฟฟ้าลดต่ำลงแล้วสามารถนำมาประจุไฟได้ใหม่ ปฏิกิริยาในระหว่างการประจุไฟจะเกิดย้อนกลับกับปฏิกิริยาการจ่ายไฟ เซลล์นิแคดจึงมีข้อดีที่สามารถใช้ได้เป็นระยะเวลานาน

2. เซลล์สะสมไฟฟ้าแบบตะกั่ว ใช้เป็นแหล่งพลังงานไฟฟ้าในรถยนต์หรือจักรยานยนต์เรียกกันทั่วไปว่า แบตเตอรี่ ถึงแม้ว่าเซลล์สะสมไฟฟ้าแบบตะกั่วจะอัดไฟใหม่ได้ แต่ก็มีการเสื่อมสภาพ เพราะ PbSO4 ที่เกิดขึ้นที่ขั้วทั้งสองบางส่วนหลุดร่วงอยู่ที่ก้นภาชนะ ทำให้ขั้วทั้งสองสึกกร่อน และทำให้เสื่อมสภาพในที่สุด
ที่มา http://school.obec.go.th/mrvilai/kindofgalvaniccell.htm







